Kesimpta fas 3-studier: ASCLEPIOS I & II
Effekten och säkerheten av ofatumumab utvärderades i två parallella, randomiserade, dubbelblinda, aktivt kontrollerade pivotala studier i fas III med identisk design ASCLEPIOS I och II (NCT02792218 och NCT02792231) med patienter i åldrarna 18 till 55 år med RMS, vars funktionsnedsättningsstatus vid screeningen gav Expanded Disability Status Scale poäng (EDSS) från 0 till 5,5 och som hade haft minst ett dokumenterat skov inom det senaste året eller två skov under de två senaste åren eller gadoliniumförstärkande (Gd positiva) lesioner vid magnetresonanstomografi (MR) undersökningar inom det senaste året. Både nydiagnostiserade patienter och patienter som bytte från sin nuvarande behandling inkluderades.
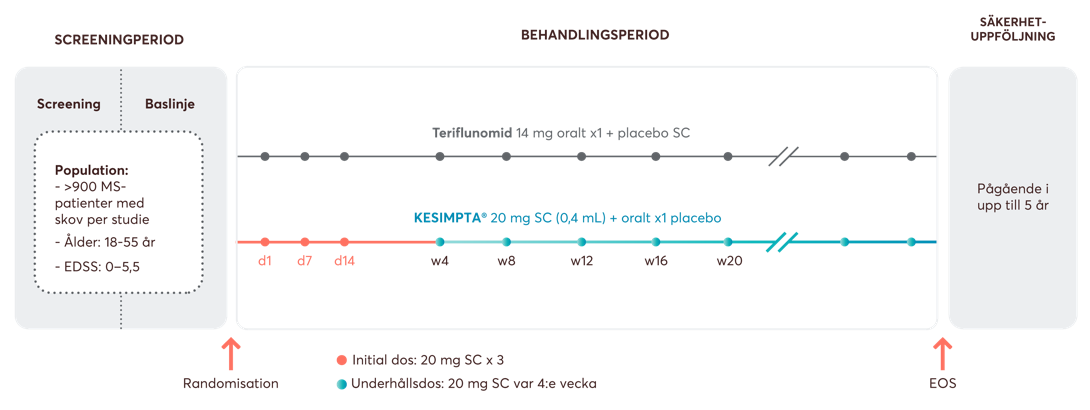
Figur 1: Studiedesign av ASCLEPIOS I & II fas 3-studier. Patienterna randomiserades till att få antingen subkutana injektioner med ofatumumab 20 mg var 4:e vecka med början vid vecka 4, efter en initial dosregim på tre doser om 20 mg per vecka under de första 14 dagarna (dag 1, 7 och 14), eller teriflunomid 14 mg kapslar oralt en gång per dag. Patienterna fick även matchande placebo som motsvarade den andra behandlingsarmen för att säkerställa blindning (dubbelplacebo design). Figur framställd av Novartis baserat på Hauser et al.1
Det primära effektmåttet för båda studierna var att demonstrera hur Kesimpta jämfört med teriflunomid minskade frekvensen av bekräftade attacker, klassificerat som årlig skovfrekvens (AAR) hos patienter som behandlats i upp till 30 månader.
Viktiga MR-effektmått var gadoliniumförstärkande (Gd+ 1) lesioner och årlig frekvens av nya eller förstorade T2-lesioner. Ett viktigt kliniskt effektmått var minskningen av risken för 3 månaders bekräftad sjukdomsprogression (3m-CDP). Behandlingstiden varierade beroende på kriterierna för avslutande av studien. Maximal varaktighet var 120 veckor, medianlängd var 85 veckor.
Säkerhets- och farmakokinetiska egenskaper hos ofatumumab mättes också under hela behandlingsperioden. 2,3
Till ASCLEPIOS-studierna1 randomiserades 1881 patienter (ASCLEPIOS I, N = 927; ASCLEPIOS II, N = 954) med RMS mellan 18 och 55 år (EDSS: 0 till 5,5). Medianuppföljningstiden i båda studierna var 1,6 år. Cirka 40 % av patienterna var behandlingsnaiva. Patienterna i båda studierna var i genomsnitt 38 år gamla och medeltiden för MS sedan det första symtomet var ca. 8 år. Den genomsnittliga EDSS var 2,9. I båda studierna kunde de flesta patienterna själva administrera Kesimpta hemma efter att de initiala doserna administrerades under överinseende av vårdpersonal. Efter den fjärde injektionen tog i genomsnitt 74,4 % av patienterna Kesimpta hemma i ASCLEPIOS I- och II-studierna.

Tabell 1: Baslinjeegenskaper i ASCLEPIOS I & II. Tabell utarbetad av Novartis baserat på Hauser et al. 1
ASCLEPIOS I & II-studierna undersökte effekten av Kesimpta mot teriflunomid gällande årlig skovfrekvens (primärt effektmått), MR-effektmått, bekräftad sjukdomsförsämring efter 3 och 6 månader samt nivåer av Neurofilament light chain (NfL).
Skov har en signifikant negativ inverkan på patienternas dagliga aktiviteter och liv.5 Frekventa attacker tidigt under sjukdomsförloppet är förknippade med långvarig progression.6
Resultaten visade att Kesimpta hade en minskning av den årliga skovfrekvensen på 50,5% i ASCLEPIOS I och 58,5% i ASCLEPIOS II, jämfört med teriflunomidbehandlade patienter (Figur 2).
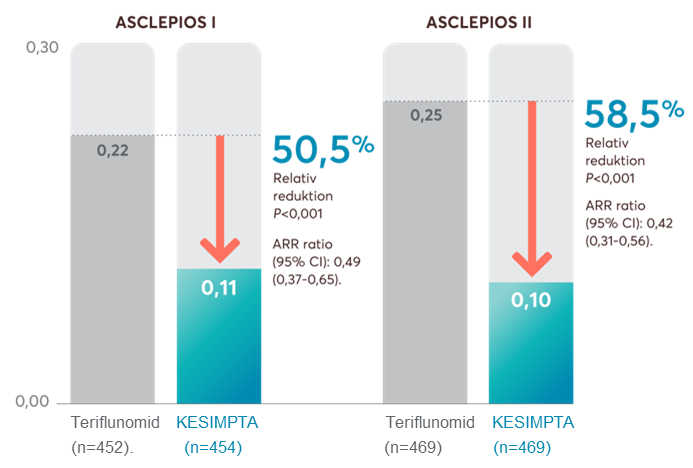
Figur 2: Ofatumumab visade en signifikant minskning av årlig skovfrekvens (ARR) jämfört med teriflunomid. Figur framställd av Novartis baserat på Hauser et al. 1
Kesimpta minskade signifikant antalet Gd förstärkande T1 lesioner med 95,9 % och frekvensen av nya eller förstorade T2 lesioner med 83,5 % (Figur 3).
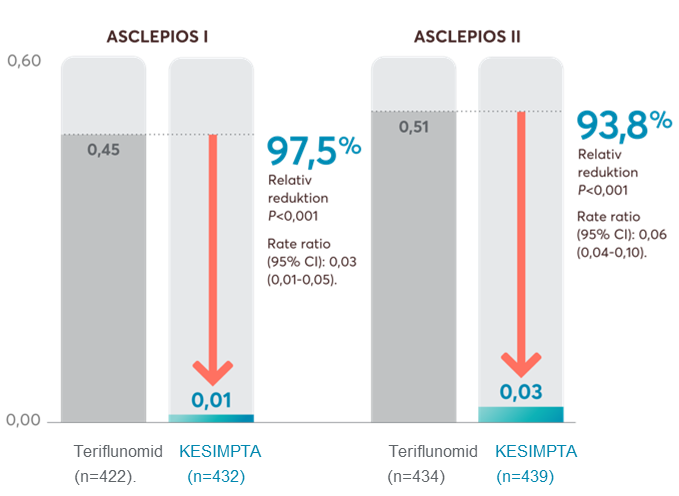
Figur 3: Ofatumumab visade en signifikant minskning av antalet Gd-förstärkande T1-lesioner (Gd+) jämfört med teriflunomid. Figur framställd av Novartis baserat på Hauser et al. 1
Resultaten visade en relativ riskreduktion på mer än 30% vid 3 och 6 månaders bekräftad progression av funktionsnedsättning på EDSS jämfört med teriflunomid (figur 4).
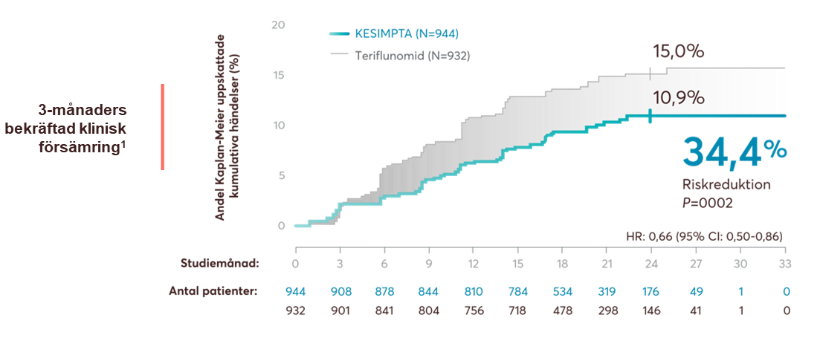
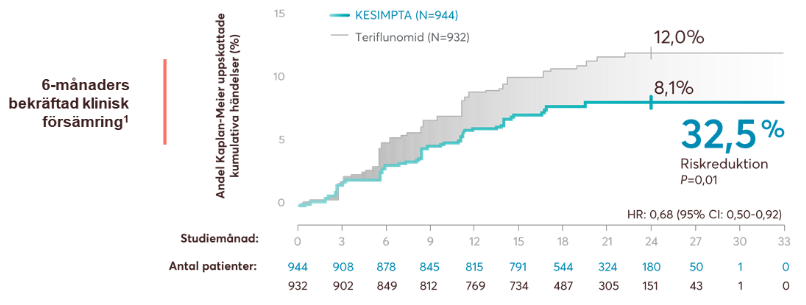
Figur 4: Kesimpta visade en signifikant minskning av tre och sex månaders bekräftad funktionsnedsättning (CDW). Figur framställd av Novartis baserat på Hauser et al.1
Andelen biverkningar var balanserade mellan ofatumumab och teriflunomid i båda fas 3-studierna, ASCLEPIOS I och II. De vanligaste rapporterade biverkningarna (≥5% i en av behandlingsgrupperna) var injektionsrelaterade reaktioner, nasofaryngit, huvudvärk och lokala injektionsreaktioner. Den totala frekvensen av infektioner och allvarliga infektioner hos patienter som behandlades med Kesimpta var liknande den hos patienter som behandlades med teriflunomid (51,6% mot 52,7% respektive 2,5% mot 1,8%)1. De injektionsrelaterade reaktionerna var i huvudsak (99,8 %) lindriga till medelsvåra.
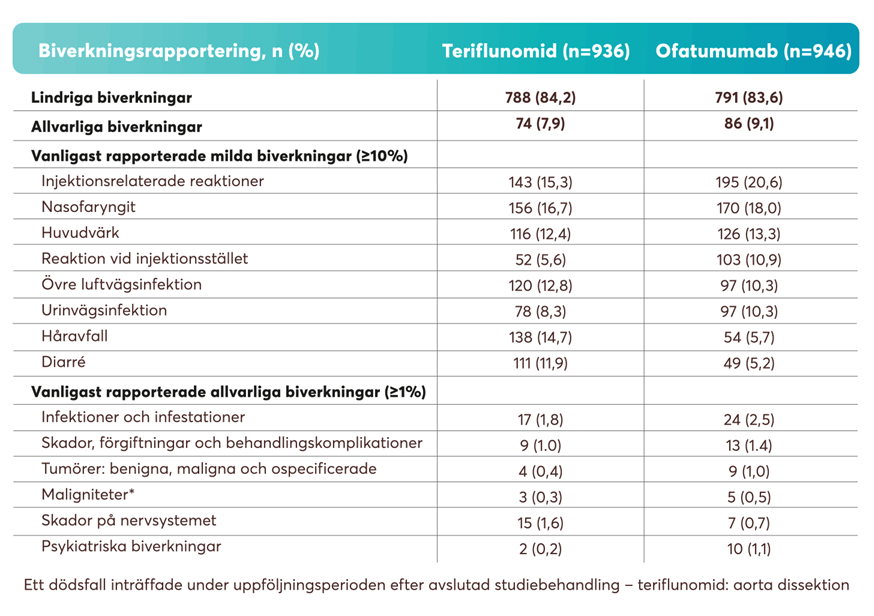
Tabell 2: Säkerhetsparametrarna från de två fas 3-studierna ASCLEPIOS I och II.1
Obs: Tabellöversikten ovan kommer att skilja sig något från de säkerhetsparametrar som anges i produktresumén för Kesimpta.4 Tabell utarbetad av Novartis baserat på Hauser et al.1
Boka möte |
 |
Håll dig uppdaterad |
Referenser
-
Hauser SL, Bar-Or A, Cohen JA, Comi G, Correale J, Coyle PK, Cross AH, de Seze J, Leppert D, Montalban X, Selmaj K, Wiendl H, Kerloeguen C, Willi R, Li B, Kakarieka A, Tomic D, Goodyear A, Pingili R, Häring DA, Ramanathan K, Merschhemke M, Kappos L; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
-
ClinicalTrials.gov Identifier: NCT02792218 (ASCLEPIOS I). Tillgänglig på: clinicaltrials.gov/ct2/show/NCT02792231
-
ClinicalTrials.gov Identifier: NCT02792231 (ASCLEPIOS II). Tillgänglig på: clinicaltrials.gov/ct2/show/NCT02792231
-
ema.europa.eu/en/documents/product-information/kesimpta-epar-product-information_no.pdf
-
Nickerson M, Cofield SS, Tyry T, Salter AR, Cutter GR, Marrie RA. Impact of multiple sclerosis relapse: The NARCOMS participant perspective. Mult Scler Relat Disord. 2015 May;4(3):234-40. doi: 10.1016/j.msard.2015.03.005.
-
Scalfari A, Neuhaus A, Degenhardt A, Rice GP, Muraro PA, Daumer M, Ebers GC. The natural history of multiple sclerosis: a geographically based study 10: relapses and long-term disability. Brain. 2010 Jul;133(Pt 7):1914-29. doi: 10.1093/brain/awq118.
-
ema.europa.eu/en/documents/product-information/kesimpta-epar-product-information_no.pdf
KESIMPTA (ofatumumab) 20 mg lösning i förfylld injektionspenna, tillhör läkemedelsgrupp selektiva immunsuppressiva medel, ATC-kod L04AG12, Rx, F Indikation: Kesimpta är avsett för behandling av vuxna patienter med skovvis multipel skleros (RMS) med aktiv sjukdom som definieras av kliniska eller bilddiagnostiska fynd. Dosering: 20 mg sc injektion vecka 0, 1 och 2, följt av månadsvis dosering som administreras av patienten själv. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Patienter med kraftigt nedsatt immunförsvar eller allvarlig aktiv infektion. Känd aktiv malignitet. Varning/försiktighet: Injektionsrelaterade reaktioner kan uppkomma, vanligen inom 24 timmar och i huvudsak efter den första injektionen. Den första injektionen ska ges under överinseende av hälso- och sjukvårdspersonal. Patienter med känd IgE-medierad överkänslighet mot ofatumumab får inte behandlas med ofatumumab. Vid misstanke om PML ska behandling med ofatumumab avbrytas. Screening för Hepatit B-virus bör utföras innan behandling inleds. Det rekommenderas att patientens immunstatus utvärderas innan behandling initieras. Hos patienter med aktiv infektion ska administreringen skjutas upp, tills infektionen har gått tillbaka. Levande eller levande försvagade vacciner bör administreras minst fyra veckor före behandling och inaktiverade vacciner bör administreras minst två veckor före behandling. Mediantid till B-cellsåterhämtning är 24,6 veckor (baserat på data från fas 3-studier). Betänk additiva effekter vid samtidig administrering av andra immunsuppressiva läkemedel. Kvinnor i fertil ålder ska uppvisa negativt graviditetstest och använda effektiv preventivmetod under pågående Kesimpta-behandling och minst 6 månader efter avslutad behandling. För fullständig förskrivarinformation, se www.fass.se. Produktresumé uppdaterad: 2025-02-03
▼ Detta läkemedel är föremål för utökad övervakning.
Novartis Sverige AB, Telefon 08-732 32 00, www.novartis.se

